Dinámica de expansión del COVID-19 en Bolivia durante las primeras 6 semanas
Resumen ejecutivo
En este documento se efectúa un análisis del patrón de propagación del COVID-19 en Bolivia empleando el modelo compartimental SEIR de matriz de próxima generación. Se simulan escenarios para analizar la dinámica de la enfermedad en las tres semanas anteriores y posteriores a la declaración de cuarentena nacional. Los resultados muestran que la velocidad de contagio disminuyó de R0=6 a R0=2.4 con las medidas impuestas. Esto permite postergar el pico de la curva de infectados en 98 días y retrasar la saturación del sistema de salud en aproximadamente 29 días, haciendo posible mejorar la capacidad de respuesta.
Introducción
En sólo tres meses la epidemia del coronavirus (COVID-19) se propagó por el mundo mostrando sus devastadores efectos, no sólo en el bienestar de las personas sino también en la economía de los países. En el corto plazo, los objetivos de salud pública apuntan a salvar vidas reduciendo la velocidad de propagación del virus para evitar que los sistemas de salud colapsen. Para ello, se han cerrado fronteras, bloqueado actividades económicas y aplicado medidas de aislamiento social con distintos grados de rigurosidad.
Bolivia es uno de los países más vulnerables a la epidemia; su sistema de salud es tan frágil que la única manera de evitar que la enfermedad se propague descontroladamente, con un alto costo en vidas humanas, es el bloqueo de actividades económicas y el aislamiento social estricto. Sencillamente, no existe capacidad suficiente para atender los casos severos (14% del total de infectados) y críticos (5% del total de infectados) en los hospitales[1].
Con la capacidad actual, estimada aproximadamente en 252 camas de internación en Unidades de Terapia Intensiva (UTI) y la existencia de aproximadamente 150 respiradores artificiales en estas unidades, el sistema de salud vería sobrepasada su capacidad cuando la cifra de infectados supere los 5,040, porque no habría espacio suficiente para internar al 5% de pacientes críticos; además, cuando se llegue a 3,000 infectados no habría la cantidad de respiradores artificiales necesarios para atender a los pacientes críticos que necesitarán ventilación asistida.
Pero mantener un régimen estricto de aislamiento social no es sencillo, la restricción selectiva de las actividades económicas produce interrupciones en la cadena de suministro y una fuerte contracción en la oferta. Como consecuencia, muchas empresas pueden volverse insolventes, puede aumentar el desempleo y la mora en el sistema bancario, disminuir el ahorro, y postergar las decisiones de inversión, contrayéndose también la demanda agregada. Lo que empezó como un shock negativo de oferta genera entonces un shock negativo de demanda, que, a su vez, afecta nuevamente a la oferta retroalimentando y amplificando la crisis.
Las posibilidades de Bolivia para enfrentar la crisis económica mediante la aplicación de medidas contracíclicas son limitadas, el país presenta elevados déficits fiscales desde hace varios años y resulta difícil pensar que una fuerte expansión del gasto y la inversión pública sean posibles sin grandes volúmenes de financiamiento externo. La estructura del empleo se caracteriza por una elevada proporción de trabajadores por cuenta propia (62.1%) que viven con lo que generan al día y que carecen de una red de seguridad social. Además, el país tiene una fuerte dependencia de las exportaciones de “commodities”, que han experimentado una fuerte caída de precios.
Todo ello configura un escenario muy complejo para tomar decisiones. Un bloqueo completo de las actividades económicas y sociales salva vidas humanas, pero produce daños severos en la economía. Por el contrario, permitir que las actividades económicas y sociales se desenvuelvan sin restricciones, puede reducir el impacto de la epidemia en la economía pero a expensas de muchas vidas humanas.
En este documento se efectúa un análisis del patrón de propagación del COVID-19 empleando el modelo compartimental SEIR[2] de matriz de próxima generación. Se simulan escenarios en Bolivia para analizar cómo se ha propagado el virus en las tres semanas anteriores y posteriores a la declaración de cuarentena nacional. Así, se estima el efecto de la cuarentena en la reducción de la tasa de contagio y en la postergación del colapso del sistema de salud
Modelo epidemiológico SEIR
La dinámica de la epidemia se resume de la siguiente manera: una o más personas infectadas se introducen en una comunidad de individuos sanos, que es susceptibles a contraer la enfermedad. La enfermedad se expande desde los infectados hacia los no infectados mediante el contacto directo entre unos y otros. Cada persona infectada recorre el curso de su enfermedad y finalmente es removido del grupo de personas infectadas bien sea porque se ha recuperado de ella o porque ha fallecido a causa de ella.
A medida que la epidemia se expande, el número de personas contagiadas aumenta, así como el número de recuperados y fallecidos. En el transcurso del tiempo la epidemia termina, y uno de los problemas más importantes es determinar si esta terminación ocurre sólo cuando no quedan individuos susceptibles a contraer la enfermedad, o si la interacción de los diversos factores de infecciosidad, recuperación y mortalidad puede resultar en la terminación a pesar de que aún existan muchos individuos susceptibles dentro de la población no afectada.
Por lo tanto, la dinámica de la epidemia depende en gran medida de la interacción social entre personas infectadas y no infectadas. El modelo SEIR modela esta interacción ubicando a las personas en cuatro estados o categorías: susceptibles (S), expuestos (E), infectados (I) y removidos (R). Cada una de esas variables representa el número de personas en esos grupos.
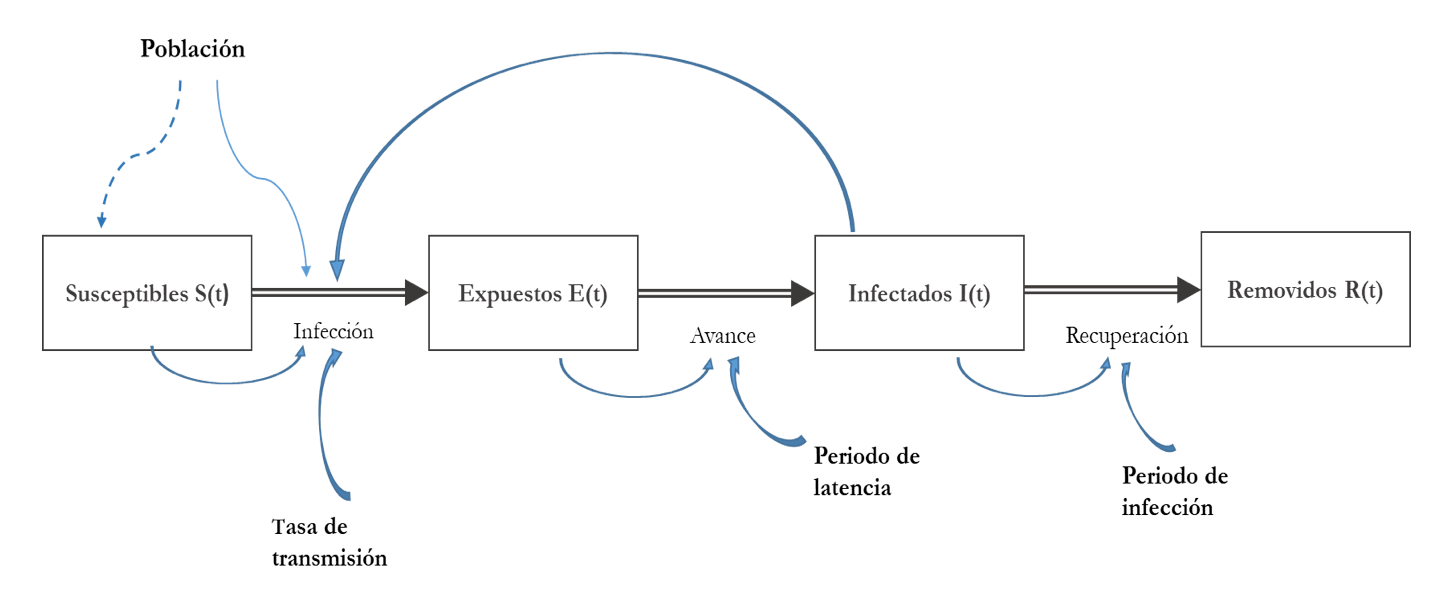
Funcionamiento del modelo:
La población total es: N = S(t) +E(t) + I(t) + R(t)
Susceptibles (S): En un inicio, cuando t=0 (momento 0), toda la población del país es susceptible a contraer la enfermedad, pero nadie está enfermo aún. Cuando aparece el primer infectado las personas susceptibles S(t) se van contagiando al entrar en contacto con una persona infectada I(t), el parámetro que controla el flujo desde el estado S(t) al estados E(t), es β β depende del número de personas con las que el infectado ha estado en contacto y de la probabilidad de transmisión.
A medida que pasa el tiempo y la enfermedad avanza, S(t) va disminuyendo porque la población ha transitado hacia otros estados. La dinámica de S(t) puede representarse por la siguiente ecuación diferencial:
$${dS\over dT} = \beta SI$$
Donde: $$\beta = tasa de contacto*probabilidad de transmisión$$
Expuestos (E): Las personas que están en este estado son aquellas que han sido infectadas, pero se encuentran en un periodo de latencia de la enfermedad gobernado por el parámetro δ. Durante el periodo de latencia no pueden transmitir la enfermedad a otras personas. La ecuación que representa el estado E(t) es la siguiente:
$${dE\over dt} = \beta SI - \sigma E $$
Donde: $${\sigma} = {1\over periododelatencia} $$
Infectados (I): Son las personas que tienen capacidad de infectar. Una parte de ellas se encuentra en la fase final del periodo de incubación del virus y aún no presenta síntomas, la otra tiene síntomas y está en un periodo íntregramente infeccioso. La ecuación que muestra la dinámica de este estado es la siguiente:
$${dI\over dt} = \sigma E - \gamma E $$
Donde: $${\gamma} = {1\over periodoinfeccioso} $$
Removidos (R): Las personas que están en este estado son los recuperados, es decir, aquellos que han superado la enfermedad y han adquirido inmunidad frente a ella, y, por lo tanto, ya no tienen la capacidad de transmitir el virus a otras personas. En este grupo también se encuentran las personas que han fallecido a causa de la enfermedad.
$${dR\over dt} = \gamma I $$
La dinámica de este modelo se determina por un parámetro crítico conocido como el número de reproducción básica (denotado por R0), que se define como el número de casos secundarios generados por un individuo infectado en una población susceptible a contraer la enfermedad, R0 puede calcularse de la siguiente manera:
$${RO} = {\beta \over \gamma} $$
Es decir:
$${RO}$$ = tasa de contacto x probabilidad de transmisión x periodo de infección
Cuando R0 es inferior a 1, una pequeña afluencia de individuos infectados no generará grandes brotes y la enfermedad desaparecerá antes de convertirse en una epidemia. Sin embargo, cuando R0 excede la unidad (R0>1), la enfermedad persistirá y tendrá el potencial de afectar a toda la población susceptible si no se toman medidas adecuadas. Resulta evidente que mientras mayor sea R0, mayor será la velocidad de propagación de la enfermedad en la población.
Supuestos del modelo:
- La población es constante y su tamaño es igual a N, es decir, las tasas de nacimiento y mortalidad son iguales durante el proceso de propagación de la enfermedad.
- No se toma en cuenta las inmigraciones y emigraciones de la población, es decir, la población es cerrada.
- La población está mezclada de manera homogénea. El proceso de transmisión de la enfermedad está regido por la ley de acción de masas.
- Los individuos que se han recuperado de la enfermedad quedan inmunes a ella, es decir, no pueden contagiarse nuevamente ni pueden transmitir el virus después de que se han recuperado.
Lo que aún no conocemos del COVID-19:
- Se ha detectado que es posible que una persona transmita el COVID-19 mientras incuba el virus, es decir, durante el periodo de latencia de la enfermedad. No obstante, se desconoce la frecuencia y el alcance en que puede ocurrir esto.
- No existe consenso sobre el intervalo de tiempo en el que un individuo con COVID-19 permanece infeccioso.
- La evidencia preliminar sugiere que las personas que lograron recuperarse de la enfermedad generaron anticuerpos que los protegen frente a ella. No obstante, se desconoce si todos los recuperados tienen este escudo protector, y si lo tuvieran, cuánto tiempo dura éste.
- Se desconoce cuál es la duración óptima de las medidas de aislamiento social.
Consideraciones sobre el número de reproducción básico (R0)
El número de reproducción básico (R0), es la medida utilizada para describir el contagio o la transmisibilidad de un agente infeccioso, su magnitud, indica el alcance potencial de un brote o epidemia. En el modelo SEIR que aquí se utiliza, estimamos R0 del modo convencional, esto es, mediante 3 parámetros: (i) la tasa de contacto entre una persona infectada con otras susceptibles (medido en número de personas por día), (ii) el número de días que dura el periodo infeccioso en una persona infectada y (iii) la probabilidad de infección por contacto directo entre una persona infectada y otra susceptible.
La aparente simplicidad en el cálculo del valor R0 puede conducir a una interpretación errónea si no se toman en cuenta los supuestos que fueron utilizados para su cálculo[3]. En este modelo los parámetros se definieron de la siguiente manera:
-
Periodo de infección = 7.5 días[4]
-
Periodo de incubación = 6 días[5]
-
Probabilidad de transmisión = 4%[6]
-
Tasa de contacto = Varía de 1 a 100 personas por día
Para estimar R0 en los periodos pre y post cuarentena se simuló 100 tasas de contacto hasta que el modelo reproduzca el número de infectados registrados en los reportes oficiales. Si bien es posible modificar los tres parámetros que componen R0 simultáneamente, es preferible mantener el periodo infeccioso como una constante biológica, sin modificar la probabilidad de infección al mismo tiempo que la tasa de contacto porque esto impediría ver el efecto marginal del aislamiento social sobre R0[7].
Debido a que R0 se ve afectado por numerosos factores biológicos, socioconductuales y ambientales que gobiernan la transmisión de la enfermedad, no es extraño que en la literatura científica se encuentren valores de R0 diferentes para un mismo agente infeccioso. En el Cuadro 1 se muestra el rango calculado para R0 para algunas enfermedades conocidas.
Cuadro 1 Valores de R0 de enfermedades infecciosas
conocidas
| Enfermedad | Tipo de transmisión | RO |
|---|---|---|
| Sarampión | Aérea | 12-18 |
| Varicela | Aérea | 10-12 |
| SARS | Gotitas en el aire | 2-5 |
| Influenza N1H1 | Gotitas en el aire | 1.4-1.6 |
| MERS | Gotitas en el aire | 0.3-0.8 |
Incluso si la infecciosidad del COVID-19 y la duración del contagio se consideraran constantes biológicas, R0 fluctuará a medida que la tasa de interacciones humano-humano varíen con el tiempo. Como las variables que afectan en el valor de R0 son contexto-específicas, no es recomendable aplicar los valores de R0 calculados para unas regiones, en otras.
Factores como la densidad de población y la organización social afectarán la tasa de contacto y por esta vía a R0. Por otra parte, el uso de máscaras y barbijos, el lavado y desinfección de manos, y la desinfección de espacios públicos, alterarán la probabilidad de contagio y de esta manera también incidirán en el valor de R0. Por lo tanto, el valor de R0 es una función del comportamiento y la organización social , así como de las características biológicas innatas del propio patógeno.
Finalmente, es importante tener en cuenta que rara vez existen sistemas de recopilación de datos suficientes para capturar el valor de R0 con precisión durante la primera etapa del brote. Como resultado, R0 se estima casi siempre retrospectivamente a partir de datos seroepidemiológicos o mediante el uso de modelos matemáticos como el que aquí se presenta. Sin embargo, muchos de los parámetros incluidos es éste y otros modelos son sólo conjeturas; los verdaderos valores a menudo son imposibles de medir directamente con exactitud.
En resumen, estimar R0 es equivalente a tener un objetivo en movimiento. El seguimiento de cada caso y la transmisión de una enfermedad es difícil, por lo que estimar R0 es complejo y desafiante. Las estimaciones a menudo cambian a medida que se dispone de nuevos datos.
Resultados
Propagación del virus y aislamiento social
El 29 de febrero de 2020 ingresó al país la primera persona infectada con COVID-19 de la que se tiene registro, tomando ese día como el día cero, se simuló la expansión del virus hasta llegar a un R0 que se ajuste al número de personas reportadas como infectadas en las estadísticas oficiales hasta el día 23 de marzo de 2020, fecha en la que entró en vigencia la cuarentena total a nivel nacional.
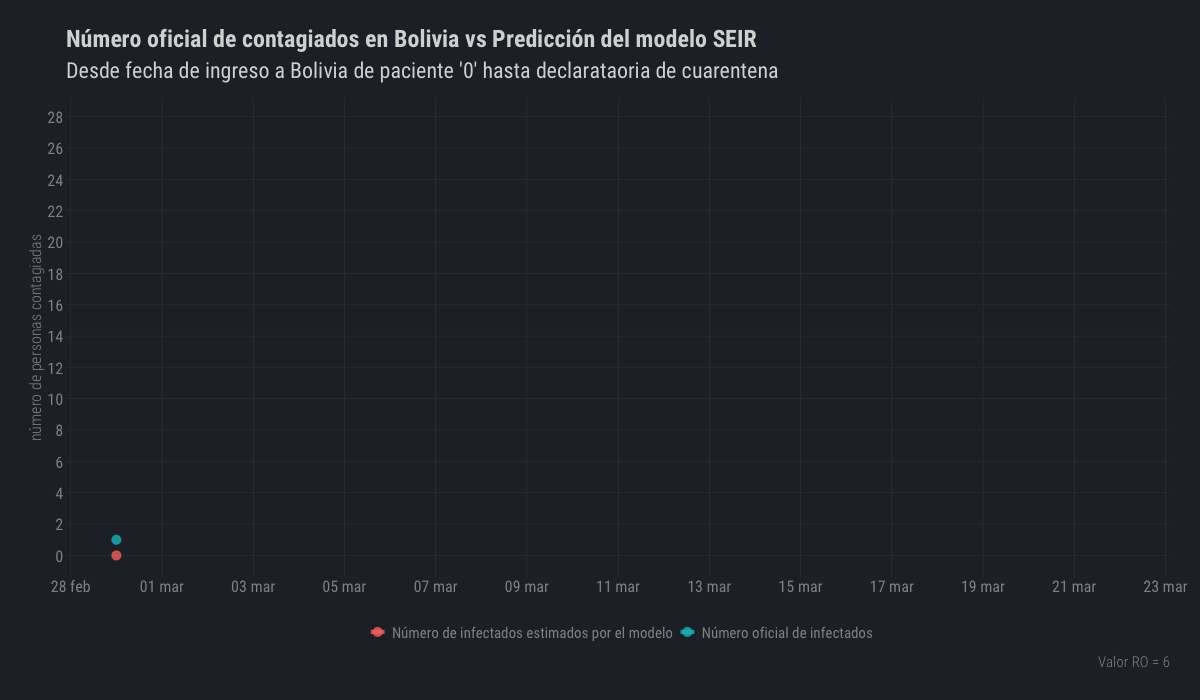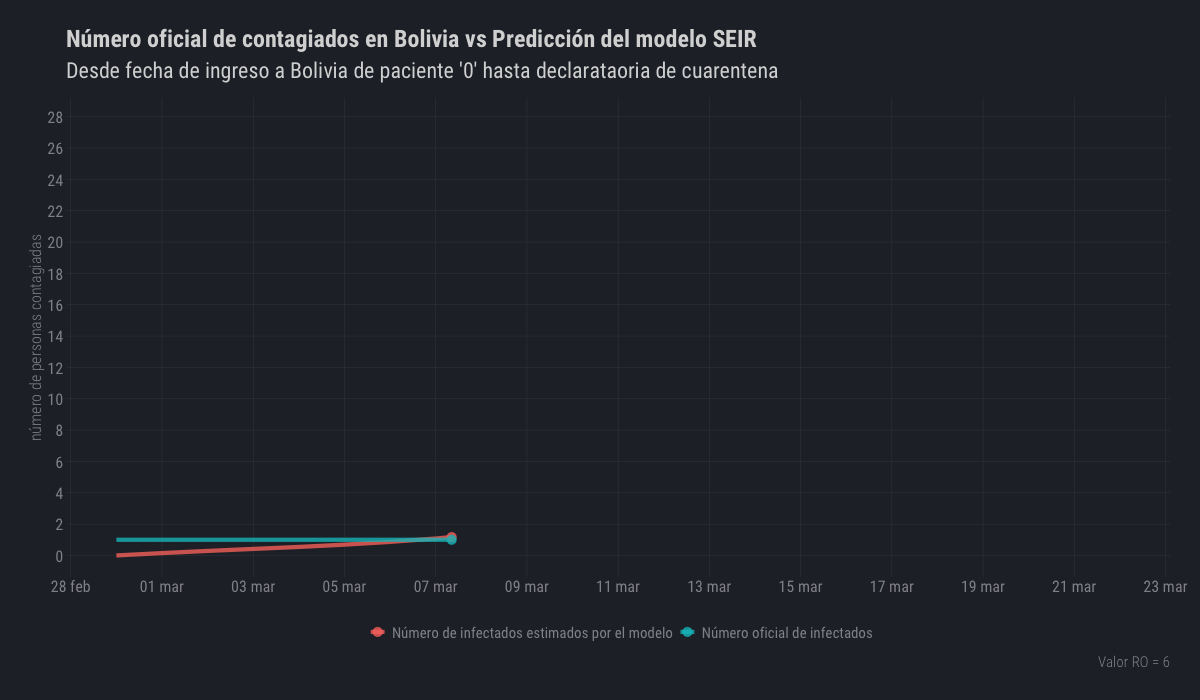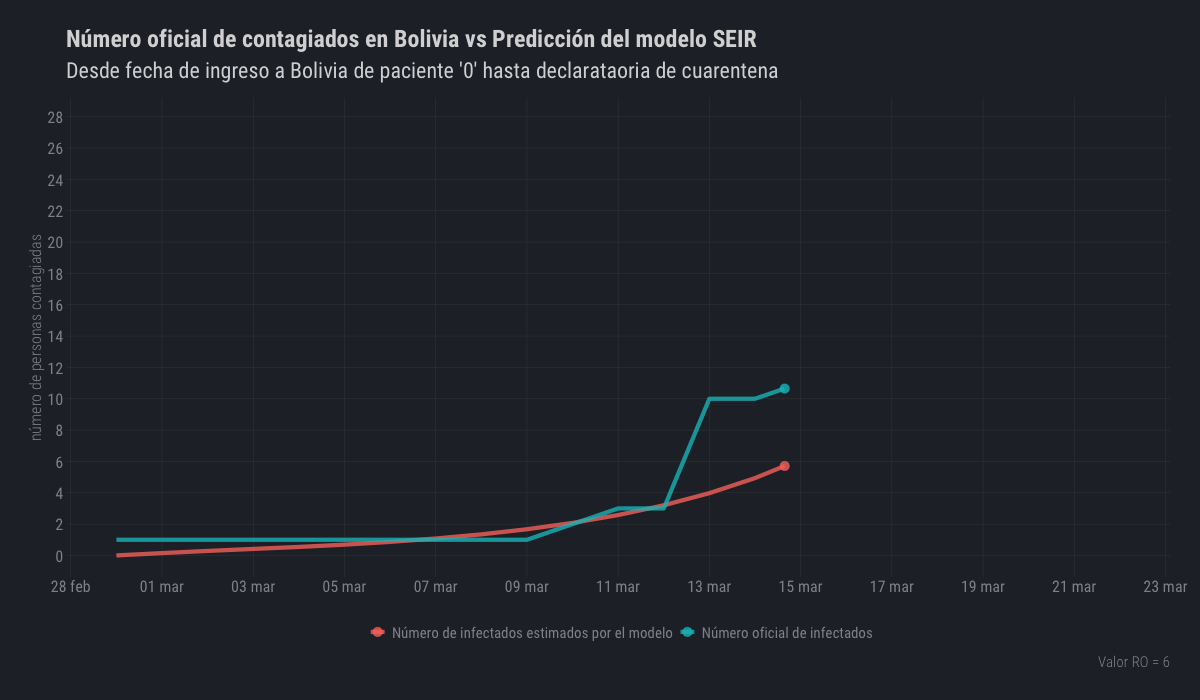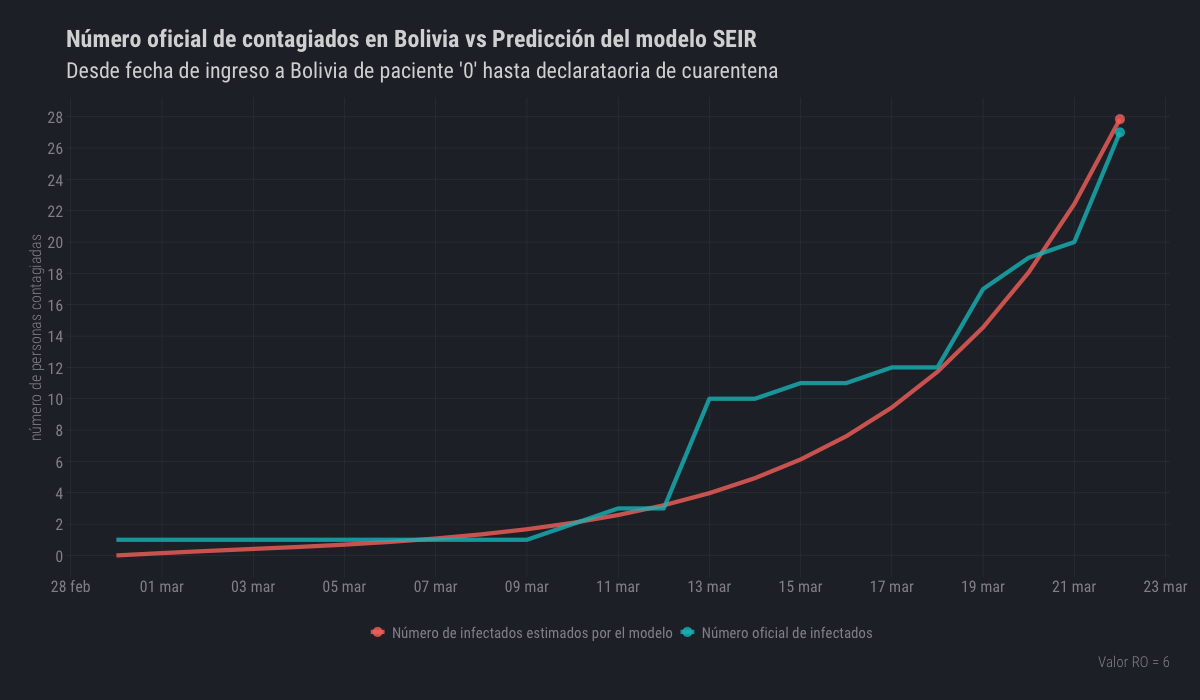
El número básico de reproducción desde el día cero hasta la entrada en vigencia de la cuarentena total fue seis (R0 = 6), lo que implica que cada persona infectada, durante el ciclo que dura su enfermedad, podía contagiar a otras 6 personas más.
| Variable | Infectados (I) |
|---|---|
| Valor real | 27 |
| Valor estimado | 27.8 |
| RO | 6 |
Si R0 se hubiera mantenido constante al nivel de 6 durante el ciclo completo de la epidemia, el pico de la curva de contagio se hubiese producido el día 87 (26 de mayo de 2020), momento en el cual el 28% de la población estaría infectada. La Figura 2 ilustra el ciclo de duración de la epidemia en ese escenario.
El gobierno de Bolivia informó el 18 de marzo de 2010 que el país dispone de 252 camas de internación en 35 unidades de terapia intensiva (UTI), además, se estima que se cuenta con 150 respiradores artificiales en las UTI a nivel nacional, aunque no se conoce la cifra exacta. Por otra parte, se conoce que un 81% de los infectados con el virus presentará síntomas leves o moderados, el 14% síntomas severos que requerirán hospitalización, y el 5% necesitará cuidados críticos con respiración asistida. Por lo anterior, resulta evidente que el primer cuello de botella del sistema es la capacidad en Unidades de Terapia Intensiva, pues si el 5% de las personas infectadas requiere este tipo de atención, el sistema colapsaría cuando se llegue a 5,040 enfermos. Sin embargo, es evidente que además de medir la capacidad del sistema de salud en número de camas de internación en terapia intensiva o en la disponibilidad de respiradores artificiales, debe tenerse en cuenta que una limitante del sistema es la cantidad de personal médico calificado para atender a los pacientes que requieran terapia intensiva.
Si R0 se mantuviera en el nivel promedio que tuvo hasta antes de la puesta en vigencia de la cuarentena, el cuello de botella medido en términos de la capacidad de internación de pacientes en terapia intensiva, se alcanzaría el día 48, es decir, el 17 de abril de 2020. No obstante, el número registrado de personas infectadas hasta el 14 de abril es de 354, lo cual conduce a pensar que las medidas de cuarentena tuvieron un efecto importante en la reducción de la velocidad de propagación de la epidemia.
Para estimar R0 en el nuevo régimen de funcionamiento social con restricciones, se simuló la expansión del virus, pero esta vez tomando como día de partida el inicio de la cuarentena, momento en el cual había 27 infectados registrados. De esa manera, ajustamos la tasa de contacto para que la predicción de infectados del modelo se ajuste al número de personas reportadas como infectadas en las estadísticas oficiales hasta el 14 de abril de 2020. En este nuevo escenario de interacción social con cuarentena R0 = 2.4, esto equivale a una reducción en la tasa de contacto entre personas infectadas y susceptibles de aproximadamente 60%.
| Variable | Infectados (I) |
|---|---|
| Valor real | 397 |
| Valor estimado | 394.2 |
| RO | 2.4 |
En la Figura 3 se muestra el ajuste entre el valor real de infectados registrados y la predicción del modelo.
Debido a que R0 > 1, cabe esperar que el número de contagios vaya en aumento, pero es evidente que la rapidez con la que se expande la enfermedad es mucho menor que en el régimen pre-cuarentena. En este nuevo escenario, el pico de la curva se alcanzaría el día 185 (1 de septiembre de 2020) posterior al ingreso de la primera persona infectada a Bolivia, momento en el cual el 12% de la población estaría infectada. El nuevo ciclo de la epidemia sería como el que se muestra en la Figura 3.
El efecto de aplanar la curva también contribuye a postergar el colapso del sistema de salud. De mantenerse el escenario de R0=2.4, el cuello de botella del sistema de salud, es decir, sobrepasar los 5,040 infectados, se alcanzaría el 16 de mayo de 2020, que corresponde al día 77 desde iniciada la epidemia.
Nótese que, en el escenario sin cuarentena (R0=6), el pico total de la curva se alcanza el día 87 (26 de mayo de 2020), pero en cuarentena (R0=2.4), el pico de la curva se alcanza recién el día 185 (1 de septiembre de 2020), es decir, 98 días después. Por otra parte, en el escenario sin cuarentena (R0=6), la capacidad del sistema de salud para atender casos críticos se sobrepasa el día 48 (17 de abril de 2020), en cambio, en un régimen de cuarentena (R0=2.4), esto ocurre el día 77 (16 de mayo de 2020), esto es, 29 días después. El tiempo ganado permite al sistema de salud aumentar su capacidad de respuesta, por ejemplo, se ha anunciado la compra de 500 respiradores automáticos para equipar a las UTIs, hay investigaciones en curso para desarrollar estos equipos internamente y se está aumentando el número de camas para cobijar a los enfermos, entre otras medidas.
Si se mantienen las medidas de aislamiento, es probable que R0 disminuya aún más en las próximas dos semanas, principalmente, porque en lo que va del periodo post-cuarentena también se contabilizan efectos rezagados del periodo pre-cuarentena, es decir, personas infectadas en el periodo anterior que estaban incubando el virus y que mostraron síntomas después.
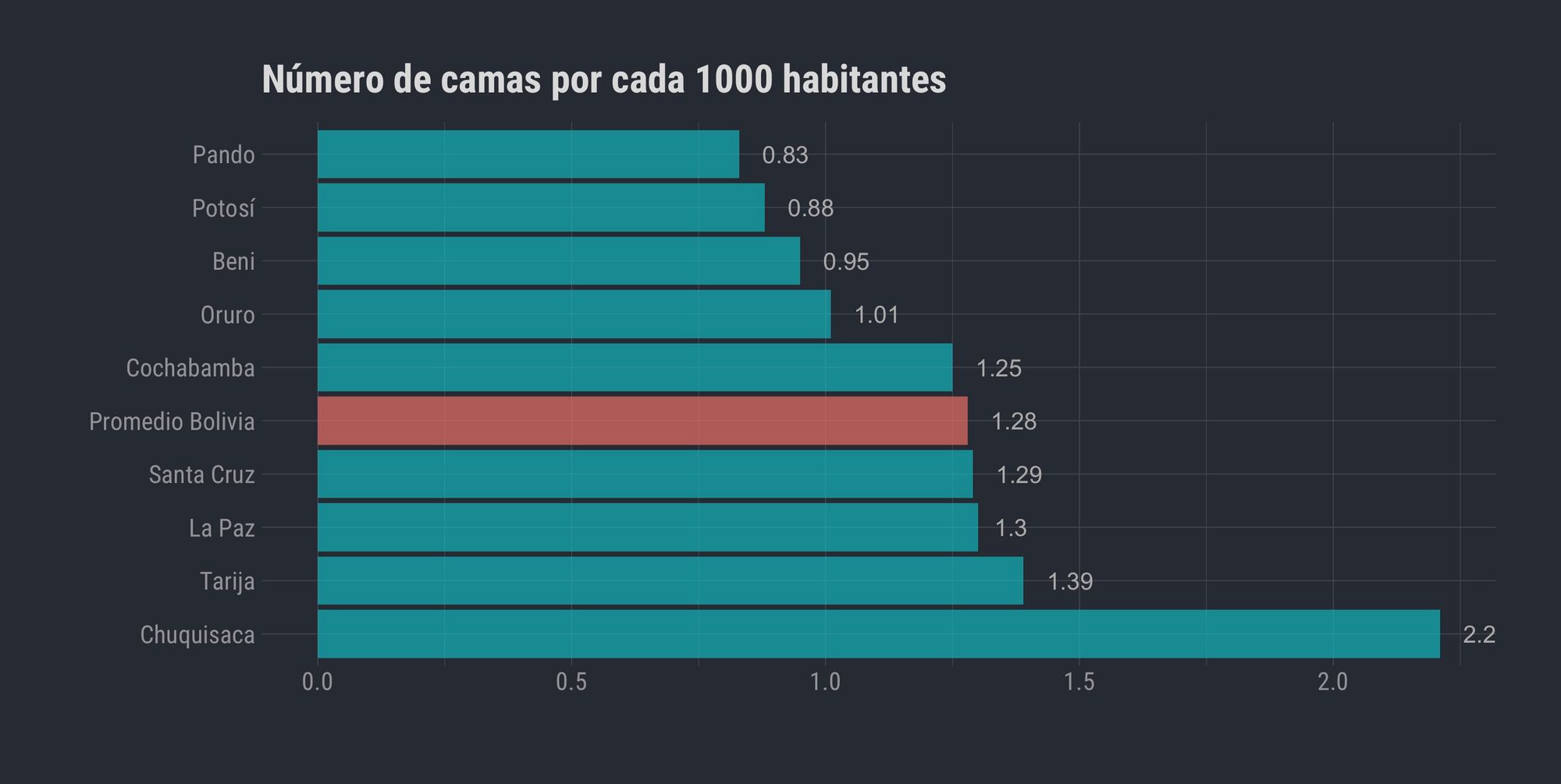
Los cálculos que presentamos en este documento no dejan de ser estimaciones promedio-país bajo los supuestos establecidos en el modelo. Sin embargo, no todos los departamentos, municipios y/o localidades tienen la misma capacidad “promedio” de respuesta, que ya es muy baja a nivel nacional. Conocer la ubicación exacta de los hospitales que pueden tratar a los pacientes con COVID-19 en estado severo, y los que cuentan, además, con unidades de terapia intensiva equipadas con respiradores artificiales para atender a los pacientes en estado crítico, es imprescindible para hacer un análisis diferenciado.
Inmunidad de grupo y fin de la epidemia
¿Cuándo terminará la pandemia del COVID-19?. Algunos piensan que estamos en la parte más empinada de la curva de contagio pero la realidad es que nos encontramos en el principio.
Las medidas de aislamiento social y de protección personal no detienen completamente el contagio, pero evitan que éste se produzca rápidamente. Esto implica que toma más tiempo llegar a un número suficiente de personas que hayan adquirido inmunidad y se logre lo que se conoce como inmunidad de grupo. Pero reducir la velocidad de propagación es necesario para evitar desbordar el sistema de salud y salvar vidas, dando tiempo a que aparezcan mejores tratamientos o una solución definitiva a través de una vacuna.
La inmunidad de grupo ocurre cuando una proporción significativa de la población ha sido vacunada o está inmunizada por algún otro mecanismo, por ejemplo, porque ha superado la enfermedad. Esto resulta en una protección para los individuos que aún son susceptibles. Cuanto mayor sea el número de personas inmunes en una población, menor será la probabilidad de que una persona susceptible entre en contacto con la infección. Es más difícil que una enfermedad se propague entre los individuos si un gran número ya es inmune, ya que la cadena de infección se rompe.
Los objetivos de inmunidad de grupo tienen relación con la magnitud de R0. El umbral crítico de inmunidad colectiva se calcula como la proporción de una población que tiene que ser inmune para que una enfermedad infecciosa se estabilice y para ello es necesario controlar la velocidad de propagación. El umbral se calcula de la siguiente manera:
$${Umbral} = 1- {ROobjetivo\over ROactual} $$
Se considera que la epidemia se estabiliza cando R0 = 1, porque cada caso conduciría a un único caso nuevo y la enfermedad dejaría de tener un crecimiento exponencial, entonces, para calcular el umbral se puede fijar este valor como objetivo. Es evidente que si se logra superar el umbral de inmunidad colectiva (R0 <1), la enfermedad se extinguiría progresivamente.
Si R0 = 6, como el que se tenía en el periodo pre-cuarentena, la epidemia se estabilizaría cuando el 83.3% de la población esté inmunizada.
Umbral~RO:6~ = $$1 - {1\over 6} = 83.3%$$
Si R0 = 2.4, como el que se midió en las tres primeras semanas del periodo post-cuarentena, la epidemia se estabilizaría cuando el 58.3% de la población inmunizada.
Umbral~RO:6~ = $$1 - {1\over 2.4} = 58.3%$$
Por lo tanto, si R0 se mantiene en niveles bajos es posible estabilizar la epidemia con una menor cantidad de personas inmunizadas, y esto debe tenerse presente tanto en las estrategias de control de la enfermedad, como en los planes de inmunización y erradicación de la misma cuando se disponga de una vacuna.
Observaciones finales
Es difícil predecir cuándo terminará la epidemia del COVID-19. Para que ello ocurra, es necesario romper la cadena de contagio estabilizando la propagación de la enfermedad, y ello se consigue cuando una gran cantidad de personas adquiere inmunidad frente al virus.
En circunstancias normales la inmunización se lograría mediante la vacunación masiva de la población, pero al no existir aún una vacuna, la única manera de lograr inmunidad de grupo es con una proporción grande de personas que se hayan recuperado de la enfermedad y generado anticuerpos frente a ella. No obstante, es fundamental controlar la velocidad de contagio para evitar desbordar la capacidad del sistema de salud, es decir, se debe procurar que el número de personas enfermas que requieren cuidados hospitalarios sea manejable por el sistema de salud.
Todavía nos falta mucho conocimiento sobre el COVID-19 y cómo se propaga, aun así, es útil realizar estimaciones sobre la dinámica de la epidemia en la medida en que nos ayude a entender mejor hacia dónde vamos con lo que sabemos. En este artículo se estimó el régimen de expansión del virus en las tres semanas anteriores y posteriores a la implementación de la cuarentena. Los resultados muestran que la velocidad de contagio disminuyó de R0=6 a R0=2.4 con las medidas impuestas; es decir, la curva se aplanó. Sin embargo, para que la epidemia entre en una dinámica de reducción progresiva es necesario que R0 <1.
De mantenerse el R0 en un nivel de 2.4, se necesitaría que el 58.3% de la población boliviana sea inmune para estabilizar la epidemia, y aún estamos muy lejos de ese objetivo. Mantener un R0 controlado ante la ausencia de una vacuna sólo es posible reduciendo el contacto social y disminuyendo la probabilidad de contagio mediante el uso de protección personal. El sistema de salud en Bolivia es tan frágil que puede verse desbordado incluso cuando estemos lejos del pico de la curva de contagio, lo que hace aún más necesario aplanar más la curva.
Si las medidas de cuarentena se relajan cuando aún hay personas infectadas que no han sido detectadas y aisladas, el brote epidémico regresará, porque aún no existe inmunidad de grupo, es decir, casi nadie es inmune. Por otra parte, es difícil saber por cuánto tiempo más la sociedad aceptará vivir en aislamiento y si la economía lo soportará.
Para flexibilizar las medidas de cuarentena es necesario al menos contar con mayor capacidad para identificar quienes están contagiados, eso permitiría implementar medidas de aislamiento selectivo evitando poner en cuarentena a toda la población. Sin embargo, para que esto sea posible es imprescindible masificar las pruebas de detección del virus, pues muchas personas infectadas no muestran síntomas o presentan síntomas leves, por lo que es muy difícil detectarlas y aislarlas selectivamente.
Por otra parte, es necesario encontrar pruebas seguras que permitan determinar quiénes poseen anticuerpos contra el virus, porque al no representar riesgos de trasmisión, estas personas podrían jugar un rol fundamental en el cuidado de los grupos de riesgo y/o reincorporarse a su trabajo para empezar a activar el sistema económico.
En resumen, las medidas de contención que se han aplicado hasta ahora han permitido ganar tiempo para preparar mejor el sistema de salud boliviano y esperar a que los científicos encuentren una vacuna o al menos tratamientos más efectivos para lidiar con esta enfermedad. Los laboratorios de investigación de todo el mundo están trabajando para encontrar vacunas eficaces, pero hasta que no se cuente con ellas es necesario reducir el contacto social y la probabilidad de contagio mediante el uso de elementos de protección personal.
Cualquier medida de flexibilización de las restricciones impuestas es arriesgada porque podría producir un rápido aumento en la tasa de transmisión del virus. Para tomar decisiones sobre este respecto es importante realizar muchas pruebas de detección de la enfermedad y monitorear la evolución de R0. Es muy probable que hasta que se encuentre una solución definitiva, la población deba acostumbrarse a vivir con medidas de aislamiento social estricto que se alternen con periodos de relativa normalidad.
Código
El código de este trabajo puede encontrarse en el siguiente repositorio: https://github.com/rafalopezv/modelo_seir_bolivia
Versión pdf
Esta publicación cuenta con el apoyo de Hivos y Fundación Avina. El contenido del análisis es responsabilidad de los autores.
Bibliografía
Delamater, P. L., Street, E. J., Leslie, T. F., Yang, Y., & Jacobsen, K. H. (2019). Complexity of the Basic Reproduction Number (R0). Emerging Infectious Diseases, 25(1), 1-4. https://dx.doi.org/10.3201/eid2501.171901.
Coburn BJ; Wagner BG; Blower S. (2009). Modeling influenza epidemics and pandemics: insights into the future of swine flu (H1N1). BMC Medicine. 7. Article 30.
Eichenbaum, Martin S. Sergio Rebelo, Mathias Trabandt. (2020). The macroeconomics of epidemics. National Bureau of Economic Research. Working Paper 26882. http://www.nber.org/papers/w26882
Guerra, Fiona M.; Bolotin, Shelly; Lim, Gillian; Heffernan, Jane; Deeks, Shelley L.; Li, Ye; Crowcroft, Natasha S. (2017). "The basic reproduction number (R0) of measles: a systematic review. The Lancet Infectious Diseases. 17 (12): e420–e428. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(17)30307-9/fulltext
Hu Z, Song C, Xu C, Jin G, Chen Y, Xu X, Ma H, Chen W, Lin Y, Zheng Y, Wang J, Hu Z, Yi Y, Shen H. (2020). Clinical characteristics of 24 asymptomatic infections with COVID-19 screened among close contacts in Nanjing, China. China Life Sci. https://link.springer.com/article/10.1007/s11427-020-1661-4
Ireland's Health Services (2020). Health Care Worker Information.
Kucharski, Adam J, Timothy W Russell, Charlie Diamond, Yang Liu, John Edmunds, Sebastian Funk, Rosalind M Eggo. (2020). Early dynamics of transmission and control of COVID-19: a mathematical modelling study. https://www.thelancet.com/action/showPdf?pii=S1473-3099(20)30144-4
Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, Sun R, Wang Y, Hu B, Chen W, Zhang Y, Wang J, Huang B, Lin Y, Yang J, Cai W, Wang X, Cheng J, Chen Z, Sun K, Pan W, Zhan Z, Chen L, Ye F.(2020). Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. https://www.ncbi.nlm.nih.gov/pubmed?term=32104917
M. H. A. Biswas, L. T. Paiva and MdR de Pinho. (2014). A SEIR model for control of infectious diseases with constraints. Mathematical Biosciences and Engineering, Volume 11, Number 4.
Kucharski, Adam and Althaus, Christian L. (2015). The role of superspreading in Middle East respiratory syndrome coronavirus (MERS-CoV) transmission". Eurosurveillance. 20(26): 14–8.
Pengpeng, Shi, Cao Shengli and Feng Peihua. (2020). SEIR Transmission dynamics model of 2019 nCoV coronavirus with consideringthe weak infectious ability and changes in latency duration.
https://doi.org/10.1101/2020.02.16.20023655
Universidad Mayor de San Andrés (UMSA). (2020). Situación y Proyecciones COVID – 19 Caso Bolivia.
Vynnycky, Emilia, Amy Trindall1, and Punam Mangtani. 2007. Estimates of the reproduction numbers of Spanish influenza using morbidity data. International Journal of Epidemiology 2007; 36:881–889.
Wallinga J, Teunis P .(2004). "Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures". Am. J. Epidemiol. 160 (6): 509–16.
Wu, Zunyou and Jennifer M. McGoogan. (2020). Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. Journal of the American Medical Association, Volume 323, Number 13. https://jamanetwork.com/journals/jama/fullarticle/2762130
Wu, Zunyou and Jennifer M. McGoogan. (2020) ↩︎
SEIR es el acrónimo de Susceptibles, Expuestos, Infectados y Removidos. ↩︎
Algunos estudios emplean para su cálculo parámetros adicionales relacionados con el aislamiento de pacientes en hospitales, la disponibilidad de recursos de salud pública, el entorno político, y otros factores que pueden influir en la dinámica de transmisión y, por lo tanto, afecta el valor de R0. ↩︎
UMSA (2020). Situación y Proyecciones COVID – 19 Caso Bolivia. ↩︎
Se emplea el valor utilizado por UMSA (2020). Un estudio, llevado a cabo por el Departamento de Epidemiología de la Escuela de Salud Pública Bloombergd de la Universidad Johns Hopkins, muestra que la estimación del periodo promedio de incubación del coronavirus es de 5,1 días. El 97,5 por ciento de las personas que desarrollan síntomas de infección por COVID-19 lo harán a los 11,5 días siguientes a la exposición. ↩︎
No existe un consenso sobre este valor, se estima que está entre 1% y 5%. ↩︎
Como la tasa de transmisión β = Tasa de contacto x Probabilidad de contagio, para efectos prácticos de simulación es indiferente modificar la tasa de contacto o la probabilidad de contagio. ↩︎
